近期,我司乔晓强教授与大连化物所生物分离分析新材料与新技术研究组(1809组)秦洪强研究员和叶明亮研究员合作,在权威期刊《Analytical Chemistry》在线发表了题为“Highly Efficient Enrichment of O‑GalNAc Glycopeptides by Using Immobilized Metal Ion Affinity Chromatography”的研究论文(DOI: 10.1021/acs.analchem.0c05236 )。
O-GalNAc糖基化(黏蛋白型O-糖基化)是蛋白质重要的翻译后修饰之一,在个体发育、肿瘤发生、细胞粘附等诸多生命活动中均发挥非常重要的作用。但是由于缺乏特异性切除O-糖链的糖苷内切酶、修饰位点没有特定的氨基酸序列、糖链结构复杂、无固定的核心结构等特点,导致对O-糖基化修饰分析仍存在一定的难度。因此,寻找一种可以在复杂蛋白质样品中选择性富集O-GalNAc糖基化肽段的富集方法,是全面分析O-GalNAc糖基化翻译后修饰的关键步骤,并将有助于更好地了解糖基化的生理功能和在疾病发生发展过程中发挥的作用。
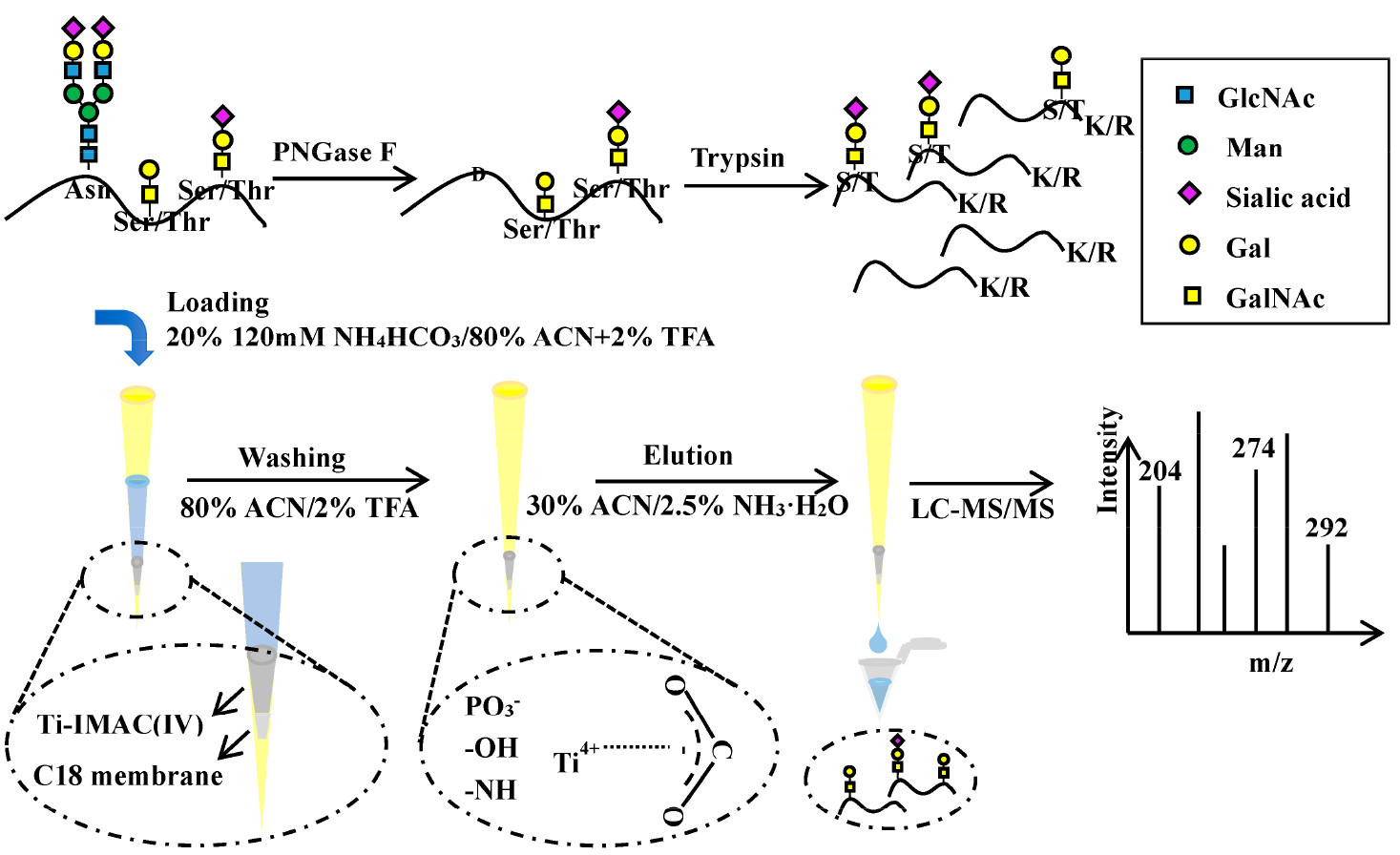
合作团队基于固定化金属离子亲和色谱Ti4+(Ti(IV)-IMAC)材料与肽段之间可以观察到强的亲水性和螯合亲和性的特点,将Ti(IV)-IMAC用于富集唾液酸化和非唾液酸化的O-GalNAc糖基化肽段。可从1 μL血清中鉴定到691个非冗余的O-GalNAc糖基化肽段和141个糖基化蛋白质。利用微量人血清样品进一步评价该富集方法,与传统的HILIC法相比,Ti(IV)-IMAC仅从0.1 μL的人血清样品中仍能鉴定出近2倍的
O-GalNAc糖基化肽段。结合高pH值的反相液相色谱(RPLC)和2D LC-MS/MS,仅从7.2 μL的人血清样品中鉴定出2,093个O-GalNAc糖基化肽段和271个糖基化蛋白质(目前为止最大的O-GalNAc糖基化数据库之一)。进一步利用该策略对HCC和对照组血清样本中不同的完整糖基化肽段进行了初步筛选,在两组样本间获得了52个明显改变的完整O-GalNAc糖基化肽段,显示了该方法在临床研究中的应用潜能。